VÁLASZOK
Sók oldáshőjének és hidratációhőjének meghatározása kalorimetriás módszerrel
1. Ha a kérdéses reakció egyenlete
![]()
akkor,
![]() ,
,
ahol D rH a reakcióhő, n i a i-ik anyag (Ai) sztöchiometriai együtthatója, Hi pedig ugyanezen anyag moláris (ill. parciális moláris) entalpiája. A reakcióhő SI egysége Jmol-1.
2. Az állandó térfogaton vett hőkapacitás:
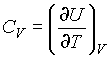 ,
,
az állandó nyomáson vett hőkapacitás pedig
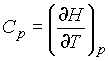 .
.
A hőkapacitás SI egysége JK-1.
3. Hess tétele: Egy reakcióval kapcsolatos energetikai változásokat (pl. D rH, D rG) a reakció kezdeti és végállapota egyértelműen meghatározza, függetlenül attól, hogy a reakció milyen köztes állapotokon keresztül zajlik le.
4. A vizsgált reakciónak lehetőség szerint mellékreakció nélkül, ismert konverzióval és jól mérhető hőeffektussal kell végbemennie. A reakciónak annyi idő alatt kell lezajlania, hogy a kaloriméter nem teljesen szigetelt mivolta miatt a környezet termikus hatását legalább számítással figyelembe lehessen venni. A kaloriméterben követni kell tudnunk egy, a vizsgált reakció hőeffektusával kölcsönösen egyértelmű kapcsolatba hozható paramétert.
5. a) A kaloriméterrel ismert nagyságú hőt közlünk elektromos fűtés útján. b) A kaloriméterben reakciót játszatunk le, melynek reakcióhőjét és végbemenetelének mértékét ismerjük.
6. NEM. Izoterm kaloriméter hőkapacitását meghatározni értelmetlen, mivel a hőmérséklet állandósága miatt a kaloriméter részei nem nyelnek el energiát, és így nem befolyásolják a mérés eredményét.
7. a) Izoterm kaloriméter (például jégkaloriméter): hőmérséklete állandó, a környezetétől termikusan elszigetelten működik, a közvetlenül mért paraméter általában egy fázisátalakuláshoz kapcsolódó térfogatváltozás vagy ennek megfelelő tömegváltozás. b) Anizoterm kaloriméter: a környezetétől termikusan elszigetelten működik, hőmérséklete a benne zajló reakció hatására megváltozik, a közvetlenül mért paraméter lehet maga a hőmérséklet vagy a hőmérséklettel
egyértelmű kapcsolatban álló egyéb paraméter (például: elektromos hőmérő feszültségjele).8. A kalorifer egy elektromos fűtőtest. Szerepe a gyakorlaton elvégzendő mérésben az, hogy általa ismert nagyságú hőt tudjunk közölni a kaloriméterrel, így lehetőség nyíljon a kaloriméter benne lévő anyagokkal együtt vett hőkapacitásának, illetve a kaloriméter „saját” (betöltött folyadék nélküli) hőkapacitásának meghatározására.
9. Lásd az 1. ábrát a mérésleírásban. Szerepelnie kell rajta a befoglaló külső köpenynek, a Dewar-edénynek, az ezt lezáró több helyen átfúrt felső dugónak, a kalorifer bemerülő részének és a hozzá kapcsolódó külső feszültségforrásnak, a mágneses keverőnek (de legalább a keverőbabának), a mintatartó csőnek az alsó záródugóval és az annak kilökésére szolgáló üvegbotnak, valamint a hőmérséklet mérésére szolgáló valamely eszköznek (higanyos vagy elektromos hőmérő).
10. A munkafázisok: a) A készülék összeállítsa: folyadék betöltés, mintatartó paraffinos szigetelése, ismert tömegű só bemérése, a mintatartó behelyezése, keverés beindítása; b) előszakasz hőmérsékleti adatainak észlelése; c) kaloriméter fűtése az első főszakasz során folyamatos hőmérséklet leolvasásokkal; d) első utószakasz és egyben második előszakasz észlelése; e) a só bejuttatása (második főszakasz); f) második utószakasz észlelése a só teljes feloldódása után.
11. A mintatartó csövet azért kell gondosan megszárítani, mert a benne maradó nedvesség a só részleges hidratációját vagy oldódását idézheti elő, így a reakciókoordináta változása más lesz, mint azt a bemérés adatai alapján várnánk. Így, az oldás során tapasztalható hőeffektus is megváltozik, és a mérés hamis eredményhez vezet.
12. Az azonos anyagmennyiségek bemérése azért lényeges, mert ez esetben az oldás után keletkező oldatok összetétele azonos lesz. Ilyen esetben az egyes sók oldáshőjében az összetételtől való függés azonos módon jelentkezik és a hidratációhő számításakor a kettő közötti különbség képzésében kiesik. A hidratációhő ez esetben a keletkező oldat összetételétő
l független lesz, megfelelően a hidratáció egyenletének, amiben csak tiszta fázisok szerepelnek.13. A feljegyzendő adatok: a) a bemért só összetétele és tömege, a bemért víz térfogata; b) hőmérsékleti adatok a mérés kezdetétől eltelt idő függvényében, végig a mérés során; c) az elektromos fűtőszál ellenállása, a fűtési szakasz kezdetének és végének időpontja, a fűtéskor alkalmazott áram vagy feszültség; d) a só bejuttatásának és teljes feloldódásának időpontja.
14. A számítás módja: Ckal=Cössz-mvízcvíz, ahol Ckal a kaloriméter melegedő részeinek (kalorifer, mintatartó cső, Dewar-edény, hőmérő stb.) hőkapacitása, Cössz a bemért vízzel együtt meghatározott hőkapacitás, mvíz a bemért víz tömege, cvíz pedig a víz fajlagos hőkapacitása. Bár ezt az adatot a további számításokban önállóan nem használjuk, mégis lehetővé teszi a mérés hitelesítését legalább annak erejéig, hogy pozitív értéket kapunk-e.
15. A szükséges folyamatok: a) kristályvízmentes só ® oldott só, ( DrH1); b) kristályvíztartalmú só ® oldott só, (DrH2); c) kristályvízmentes só ® kristályvíztartalmú só, (DrH3). Ezekből a kristályhidratáció reakcióhője: DrH3=DrH1-DrH2 .
16. Igen, lehetséges, ennek nincs termodinamikai akadálya. Ha a kristályvíz felvétele spontán megy végbe, akkor a D rG=D rH-TD rS összefüggés és a kristályhidratáció során a konfigurációs entrópia csökkenése miatt a hidratációnak kellően exoterm folyamatnak kell lennie. Ez nem határozza meg azonban az oldódásokkal kapcsolatos hőeffektusok előjelét, csupán azok különbségére nézve szab korlátozó feltételt.
17. Lásd az 2. ábrát a mérésleírásban.. Megfelelően feliratozott vázlatos J vs. t grafikont kell rajzolni kétlépcsős görbével, közöttük az x tengellyel közel párhuzamos szakaszokkal. Az első lépcsőben a hőmérséklet-változás mindenképpen pozitív (fűtés!). A bejelölendő szakaszok: a, első előszakasz; b, első főszakasz; c, első utószakasz és második előszakasz egyben; d, második főszakasz; e, második utószakasz.
18. Az elő- és utószakaszok során észlelt hőmérsékleti adatokat arra használjuk, hogy meghatározzuk a kaloriméter hőmérsékletét a kívánt folyamat lezajlásának hipotetikus pillanatában. Ezzel egyrészt a leolvasások véletlen hibáit és a spontán fluktuációk hatását csökkentjük, másrészt a leolvasásnál több értékes jegyre számolva az extrapolált adatokat a számítás pontosságát növeljük. Az elő- és utószakaszok során leolvasott adatokból állapítjuk meg azt is,
hogy a hőmérsékletnek van-e a mérési pontosságot vagy a környezet csekély befolyásoló hatását meghaladó időbeni változása, azaz: a vizsgált rendszerben a hőmérséklet-különbségek kiegyenlítődtek-e. Ezen megfigyelés segítségével hozhatunk a mérés közben döntést arról, hogy befejezhető-e az egyes szakaszok észlelése, és folytatható-e a mérés egy további szakasszal.19. A mérés relatív hibájának megbecsülésére a relatív hibát a hőmérséklet mérésére szolgáló eszköz leolvasási hibájának és a mérések szakaszai között észlelt legkisebb hőmérséklet-különbségnek a hányadosával azonosítjuk. (További lehetőség lenne több párhuzamos mérés elvégzése és azok szórásának statisztikai vizsgálata is, több azonos mérés végzésére a gyakorlat ideje alatt nincs mód. Sok párhuzamos hallgatói mérés esetén azonban ez a mód volna ajánlatos.)