
Sn-Pb ötvözet termikus analízise, fázisdiagram megszerkesztése
A szükséges elméleti háttér
- a fázisegyensúly termodinamikai feltétele;
- fázistörvény (komponens, fázis, szabadsági fok fogalma);
- tiszta anyagok fázisdiagramja: olvadáspont, hármaspont, forráspont, kritikus hőmérséklet (a víz és a széndioxid fázisdiagramja);
- az ón-ólom rendszer fázisdiagramja, eutektikum;
Eszköz- és méréstechnikai ismeretek
- hőmérséklet mérése termoelemmel
Bevezetés:
A legegyszerűbb heterogén egyensúlyok az egykomponensű rendszerek különböző fázisai között jönnek létre. A szilárd-folyadék, illetve folyadék-gőz egyensúlyokon kívül ide soroljuk az allotróp módosulatok egyensúlyait is. Az előbbiekre az olvadáspont, ill. forráspont a jellemző, az utóbbira az egyes módosulatok közötti átváltozási hőmérséklet. A gyakorlatban fontos a többkomponensű heterogén rendszerek, például oldószer/oldott anyag rendszer vagy két fém ötvözete, szilárd-folyadék egyensúlya is. Az alábbiakban csak az Sn-Pb rendszerrel foglalkozunk, ami a szilárd-folyadék fázisátmenetek közül azt az egyszerű esetet képviseli, amikor a komponensek sem vegyületet, sem szilárd oldatot nem képeznek egymással, csupán egyetlen eutektikumot. (Ilyen típusú kétkomponensű rendszert alkot a víz különböző sókkal (pl.: NaCl, KCl, karbamid, stb.)).
A különböző fázisok egyensúlyi viszonyait általában fázisdiagramon ábrázoljuk. Erre egy példa a többkomponensű rendszerek olvadáspontjának az összetétellel való változását állandó nyomáson feltüntető diagram. (A nyomás rögzítése eggyel csökkenti a szabadsági fokok számát!) A fázisdiagramok megszerkesztéséhez szükséges lehűlési görbéket nyitott edényben, légköri nyomáson vesszük fel. Ezért a gőzfázissal nincs egyensúlyban a folyadék és szilárd fázis, gyakorlatilag nincs gőzfázisunk, hiszen az ón és ólom gőznyomása az olvadáspont közelében nagyon kicsi a légköri nyomáshoz viszonyítva.
Az 1. ábrán jól látható, hogy az ilyen típusú rendszerekben akár az A anyagot adagoljuk a B anyaghoz, akár viszont, a tiszta k
omponenseknek megfelelő fagyásponthoz képest mindig fagyáspontcsökkenés lép fel. Ez egyben azt is jelenti, hogy a hőmérséklet csökkentésével mindegyik komponensnek a másikban való oldhatósága csökken és viszont. Ha a telítetlen oldat tartományába tartozó, z ponttal jelzett hőmérsékletű és összetételű oldatot vagy olvadékelegyet hűteni kezdjük, egy ideig az elegy összetétele nem változik. Elérve az A' pontnak megfelelő hőmérsékletet, az oldat (olvadékelegy) telítetté válik az A komponensre nézve. Elértük ekkor a megfelelő összetételű oldat fagyáspontját, megjelenhet tehát a rendszerben egy szilárd fázis. További hűléskor az A oldhatóságának a hőmérséklet csökkenésével fellépő csökkenése miatt mind nagyobb mennyiségben válik ki a szilárd A komponens, és ennek megfelelően mind kevesebbet fog a telített oldat az A komponensből tartalmazni. A telített oldat összetétele tehát a nyílaknak megfelelően fog eltolódni a likvidusgörbe mentén. Ilyenkor a tiszta A komponens kristálykái úsznak a változó összetételű olvadékban.Amikor a hűtéssel elértük a
TE eutektikus hőmérsékletet - amelynél kisebb hőmérsékleten folyékony fázis nem lehet a rendszerben- , az oldat (olvadékelegy) összetétele eutektikus összetételű lesz. Az oldat (olvadékelegy) ezen a hőmérsékleten telítetté válik a másik (B) komponensre is, és megindul ennek a kiválása, kikristályosodása is.Az eutektikus összetételű oldat tehát egyensúlyt tart mindkét szilárd komponenssel. Az eutektikus hőmérsékleten az oldattal egyensúlyban lévő két szilárd fázis olyan arányban válik ki, hogy közben az oldat összetétele már tovább nem változik. További hűtésnél tehát az elegy a folyadékfázisbani összetétellel dermed meg az eutektikus hőmérsékletnek megfelelő éles fagyáspontján, hasonlóan, mint a tiszta elemi komponens vagy valamely sztöchiometrikus vegyület. Az eutektikum azonb
an nem sztöchiometrikus összetételű vegyület, ezt bizonyítja az is, hogy összetétele a nyomás változtatásával megváltozik, ami a sztöchiometrikus vegyületek esetében nem lehetséges.(Eutektikum
(görög; eutektos = könnyen olvadó): Két vagy több olyan anyag jellegzetes elegye, amelyek egymással homogén folyadékot (olvadékot, v. oldatot) képeznek, szilárd állapotban azonban nem elegyednek. Ilyenek például NH4Cl + H2O, NaCl + H2O, Zn + Cd, Sn+Pb stb. Vegyületek is alkothatnak eutektikumot pl. a lítium-nitrát és a kálium-nitrát eutektikus pontja 129 oC. Az eutektikum olvadáspontja alacsonyabb valamennyi komponens olvadáspontjánál!)Ha az y
pontból kiindulva hűtünk, akkor a kristályosodás menete hasonló lesz az előbbihez, a B' pont elérése után azonban nem az A komponens, hanem a tiszta B komponens (vizes sóoldatok esetében a só) kezd kikristályosodni egészen az eutektikus pont eléréséig, amikor is a másik komponens is kiválik. Ilyenkor a tiszta B komponens kristálykái úsznak a változó összetételű olvadékban.Az Sn-Pb rendszer esetében két komponens van (Sn, Pb), mindenütt. Az olvadék fázisban (y, z pontok), F=1, (hiszen gyakorlatilag nincs gőzfázis), K=2, így Sz=3. Mivel a nyomás rögzített, ezért az összetétel és a hőmérséklet értéke választható szabadon. Az olvadáspont görbéken (A', B') F=2, K=2, így Sz=2, a p rögzített ezért vagy a T, vagy az összetétel választható szabadon. Az eutektikus pontban F=3 (olvadék, szilárd Sn, és szilárd Pb), K=2, így Sz=1. A p rögzített ezért ebben a pontban sem a T, sem az összetétel értéke nem választható meg szabadon.
1. ábra

Olvadáspont-összetétel diagram
Az átváltozási hőmérséklet meghatározására felhasználható minden olyan sajátság (tulajdonság), amely az átváltozási hőmérsékleten ugrásszerűen változik. Ilyen pl. a szín, elektromos vezetés, fajlagos térfogat, stb. Ha a fázisátmenet entalpiaváltozása nem nagyon kicsi, akkor a legegyszerűbben felmelegedési vagy lehűlési görbék alapján meghatározható az átváltozási hőmérséklet, és megszerkeszhető a fázisdiagram.
Mérési feladat
Különböző összetételű Sn-Pb ötvözetek lehűlési görbéinek felvétele és a fázisdiagram ezek alapján történő megszerkesztése.
Mérőberendezés
A lehűlési adatok felvételét számítógépvezérelt mérésadatgyűjtő rendszerrel végezzük. Az ötvözetek megolvasztása elektromos fűtésű kemencében történik.
A hőmérsékletet vas-konstantán termoelemekkel mérjük
Eszközök, anyagok
A mérőberendezés teljesen összeállítva megtalálható a mérőhelyen. A kemencék tartalmazzák a feltüntetett összetételű Pb-Sn ötvözeteket. Az fémeket a levegő oxigénjének oxidáló hatásától úgy védjük meg, hogy szénporral fedjük le őket, ami oxidációja révén az oxigént távol tartja. Ezt megtehetjük, mivel egyik szóban forgó fém sem karbidképző. A tartóedény anyagával való reakció elkerülése érd
ekében kvarccsöveket alkalmazunk.A mérés kivitelezése:
A lehűlési görbék felvételeA számítógépvezérelt adatgyűjtő rendszert a mérőhelynél kifüggesztett útmutató alapján bekapcsoljuk, és a programot elindítjuk. A rendszert mindaddig nem szabad felügyelet nélkül hagyni, amíg a számítógép ki nem kapcsolta a kemence fűtését, és át nem tért a lehűlési adatok tárolására.
A mérési adatok kiértékelése
A mérés időigényességére való tekintettel nem biztos, hogy az általunk indított adatgyűjtés eredményét értékeljük, hanem esetenként az oktatók által adott korábbi adathalmazt. A fázisdiagramnak a lehűlési görbék alapján történő megszerkesztését szemléletesen mutatja a 2. ábra.
Az értékelést az alábbi pontoknak megfelelően célszerű elvégezni (a leírtakkal k
apcsolatban érdemes kikérni az oktatók pontosító magyarázatát is):1. A lehülési adatok ábrázolása grafikus értékelő program segítségével.
2. Az olvadáspontokat és az eutektikus hőmérsékletet jelző helyi maximumok, töréspontok vagy platók megkeresése a lehűlési görbéken. Töréspont helyének pontos meghatározásához a lehűlési görbe töréspont előtti és utáni rövid egyenes szakaszaira egyeneseket illesztünk, és ezek metszéspontjának y-koordinátája adja az olvadáspont értékét. A fázisátmenetekhez tartozó te
rmofeszültség adatokat az értékelő adatlap első oszlopába írjuk.3. A termofeszültség skála kalibrálása (hőmérséklet-termofeszültség megfeleltetés). A hőmérséklet és a termofeszültség kapcsolatát lineáris függvénnyel írjuk le. Ehhez négy adatpár áll rendelkezésünkre. A 0 °C referencia-hőmérséklethez 0 mV tartozik. A tiszta anyagok olvadáspont értékeit ismerjük az irodalomból, a hozzájuk tartozó termofeszültségeket a lehűlési görbékről mi olvassuk le. Ezenkívül ismerjük egy harmadik tiszta fém, a cink olvadáspontját, s az ennek az olvadáspontnak megfelelő termofeszültséget is. A négy adatpárra illesztett egyenes paramétereit a legkisebb négyzetek módszerével határozzuk meg. A kalibrációs egyenes egyenlete:
![]()
4. Az olvadás- és eutektikus pontok termofeszültség adatait a kalibrációs függvény segítségével átszámítjuk Celsius fokra. Az olvadáspont adatokat négy é
rtékes jegyre kell megadni. A méréshez kiadott értékelő adatlap második oszlopába kerülnek a olvadáspont adatok.5. A fázisdiagram megszerkesztése grafikus értékelő program segítségével, vagy milliméter papíron. Ábrázoljuk mind az olvadáspont, mind az eutektikus hőmérséklet adatokat az összetétel függvényében. A fagyáspont adatokra harmadfokú polinomot illesztünk (a két ágra külön-külön), és ezzel közelítjük az olvadáspont (fagyáspont) görbéket. Milliméter papíron történő ábrázolásnál az olvadáspont adatokra folytonos monoton görbét húzunk. Az eutektikus pontokra az összetétel tengellyel párhuzamos egyenest húzunk. Eutektikus hőmérsékletként a mért adatok átlagát fogadjuk el.
Az eutektikus összetétel megállapításához a fázisdiagramnak azt a részét ahol a két olvadáspont görbe találkozik kinagyítjuk, majd leolvassuk az eutektikus összetételt. Amennyiben milliméter papíron készítjük a fázisdiagramot, akkor ugyanígy járunk el, csak nem kell kinagyítani az említett részt.
A kiértékeléshez szükséges adatok:
az ón olvadáspontja: 231,9 ° C
az ólom olvadáspontja: 327,4 ° C
a cink olvadáspontja: 420,0 oC
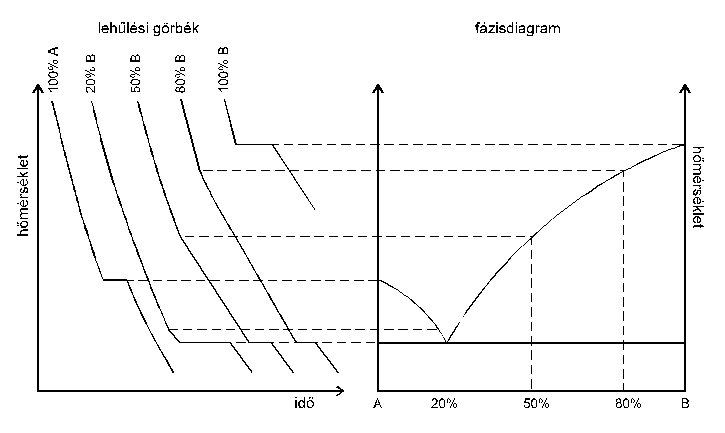
2. ábra
Idealizált lehűlési görbék és a fázisdiagram ezek alapján történő megszerkesztésének elve
A mérési eredmények megadása
1. a termoelem kalibrációs függvény grafikonja és egyenlete;
2. értékelő adatlap (az adatfile nevével);
3. a fázisdiagram (milli
méter papíron vagy grafikus értékelő szoftverrel elkészítve);az eutektikus összetétel megadása a fázisdiagramról leolvasva (3 értékes jegyre);
4. az eutektikus hőmérséklet megadása a 95%-os statisztikus biztonsághoz tartozó
hibahatárokkal. (A hibahatárok számítása a minta alapján.)